Antibiotika in der modernen Medizin und die steigende Bedrohung durch Antibiotikaresistenzen
Einleitung
Die Entdeckung der Bakterien und die sich anschließende Entwicklung von Antibiotika haben die Medizin grundlegend und dauerhaft verändert. Bevor wir die heutigen Herausforderungen betrachten, ist es wichtig, die historischen Meilensteine zu verstehen, die zu unserer aktuellen Situation geführt haben. Wichtige historische Schritte auf dem Weg zu Antibiotika:
- Antonie van Leeuwenhoek (1632-1723, Delft, Niederlande) war ein Pionier der Mikroskopie und entdeckte Bakterien im 17. Jahrhundert.
- Ferdinand Cohn (1828-1898, Breslau, Deutschland) leistete einen wichtigen Beitrag zur Klassifizierung von Bakterien im 19. Jahrhundert. Louis Pasteur (1822-1895, Paris, Frankreich) entwickelte die Theorie der biogenen Abstammung und leistete bahnbrechende Arbeit zur Erforschung von Bakterien und Impfstoffentwicklung im 19. Jahrhundert.
- Ernest Duchesne (1874-1912, Paris, Frankreich): Entdeckte bereits in den 1890er Jahren die möglichen antibakteriellen Eigenschaften von Pilzen, insbesondere Penicillium. Seine Arbeit wurde jedoch zu seiner Zeit nicht ausreichend anerkannt.
- Robert Koch (1843-1910, Berlin, Deutschland) entwickelte die Kochschen Postulate zur Identifizierung von Krankheitserregern und isolierte wichtige pathogene Bakterien im 19. Jahrhundert.
- Die eigentliche Revolution in der medizinischen Behandlung von bakteriellen Infektionen kam jedoch im 20. Jahrhundert mit der Entdeckung von Penicillin durch Alexander Fleming (1881-1955, London, Vereinigtes Königreich). Dieses erste Antibiotikum revolutionierte die Medizin und rettete unzählige Leben.
Antibiotika spielen eine entscheidende Rolle in der modernen Medizin. Diese bahnbrechenden Entdeckungen revolutionierten die medizinische Praxis und ermöglichten lebensrettende Fortschritte. Sie bilden die Grundlage heutiger medizinischer Praktiken, die nun vor neuen Herausforderungen stehen – vor allem der wachsenden Bedrohung durch Antibiotikaresistenzen
Die Bedeutung von Antibiotika in der Medizin
Nachdem wir die historischen Grundlagen betrachtet haben, erkennen wir, wie die Entdeckung der Antibiotika im 20. Jahrhundert die medizinische Behandlung revolutioniert hat. Diese Medikamente haben zu einer signifikanten Verringerung der Sterblichkeitsraten bei bakteriellen Infektionen geführt. Vor der Ära der Antibiotika waren viele Infektionen, die heute als behandelbar gelten, oft tödlich. Krankheiten wie Lungenentzündung, Tuberkulose und Sepsis waren weit verbreitet und schwer oder gar nicht zu behandeln. Mit der Einführung von Antibiotika änderte sich das Bild der Allgemeinen Gesundheit dramatisch. Diese Medikamente ermöglichten es Ärzt:innen und Pflegepersonal, effektiv gegen bakterielle Infektionen vorzugehen und Leben zu retten.

Lewis K (2020). The Science of Antibiotic Discovery. Cell, 181(1):29–45.
Heutzutage sind Antibiotika unverzichtbar in der Gesundheitsversorgung. Sie werden nicht nur zur Behandlung von Infektionen verwendet, sondern sind auch im Umfeld von Operationen, bei der Verabreichung von Chemotherapien und bei der Behandlung von chronischen Erkrankungen. Die Möglichkeit, Infektionen zu kontrollieren, hat die Medizin revolutioniert und Behandlungen ermöglicht, die ohne diese Medikamente undenkbar wären.
Jedoch bedroht die zunehmende Verbreitung von Antibiotikaresistenzen diese lebensrettenden Errungenschaften, indem sie die Wirksamkeit der Medikamente untergräbt. Durch natürliche Selektion und genetische Anpassungen entwickeln Bakterien Widerstandsfähigkeiten gegen die Medikamente, was sie weniger wirksam oder sogar unwirksam macht. Dies führt zu einer neuen Herausforderung in der medizinischen Praxis, da resistente Stämme schwerer zu behandeln sind und die Gefahr von Krankheitsausbrüchen erhöhen.
Die Herausforderung der Antibiotikaresistenzen
Bedeutung der Antibiotikaresistenzen
Vor dem Hintergrund der Bedeutung von Antibiotika ist es umso beunruhigender, die tiefgreifenden und weitreichenden Auswirkungen von Antibiotikaresistenzen (AMR) auf die globale Gesundheit und Wirtschaft zu betrachten. Eine systematische Analyse aus dem Jahr 2019 liefert erschreckende Zahlen, die das Ausmaß des Problems verdeutlichen.
Geografische Verteilung: Die geografische Verteilung von Antibiotikaresistenzen zeigt weltweit deutliche Unterschiede, wobei Länder mit niedrigem und mittlerem Einkommen oft höhere Resistenzraten aufweisen. Mehrere Faktoren tragen zu diesen geografischen Disparitäten bei. Ein Grund ist der leichtere Zugang zu Antibiotika in einigen Regionen, der zu unsachgemäßem und übermäßigem Gebrauch führt. Ohne strenge Verschreibungsvorgaben werden Antibiotika oft ohne angemessene medizinische Indikation verwendet, was die Entwicklung von Resistenzen begünstigt. Dazu trägt die Qualität der medizinischen Infrastruktur und der allgemeine Wissensstand über den korrekten Einsatz von Antibiotika als entscheidende Faktoren bei.
Zudem fehlen häufig die notwendigen diagnostischen Einrichtungen, was zu einer „Blindbehandlung“ führt und den falschen Gebrauch von Antibiotika weiter fördert. Unzureichende Hygienepraktiken, besonders in Krankenhäusern und Kliniken, ermöglichen es resistenten Bakterien, sich schnell zu verbreiten. Diese Einrichtungen, die eigentlich der Gesundheitspflege dienen sollten, können so zu Brutstätten für resistente Keime werden. Begrenzte finanzielle und personelle Ressourcen verschärfen die Situation und verhindern eine effektive Infektionskontrolle und -überwachung, was in der Folge eine angemessene Reaktion auf das wachsende Problem der Antibiotikaresistenzen verhindert.
Anzahl und Verteilung der Todesfälle: Von den geschätzten 55 Millionen Todesfällen weltweit im Jahr 2019 waren etwa 9% – das entspricht rund 4,95 Millionen Todesfällen – mit Antibiotikaresistenzen assoziiert. Davon waren etwa 2,31%, also ungefähr 1,27 Millionen Todesfälle, direkt auf Antibiotikaresistenzen zurückzuführen. Diese Zahlen zeigen, dass Antibiotikaresistenzen eine signifikante und wachsende Bedrohung für die öffentliche Gesundheit darstellen, mit einem beachtlichen Anteil an der weltweiten Mortalität.
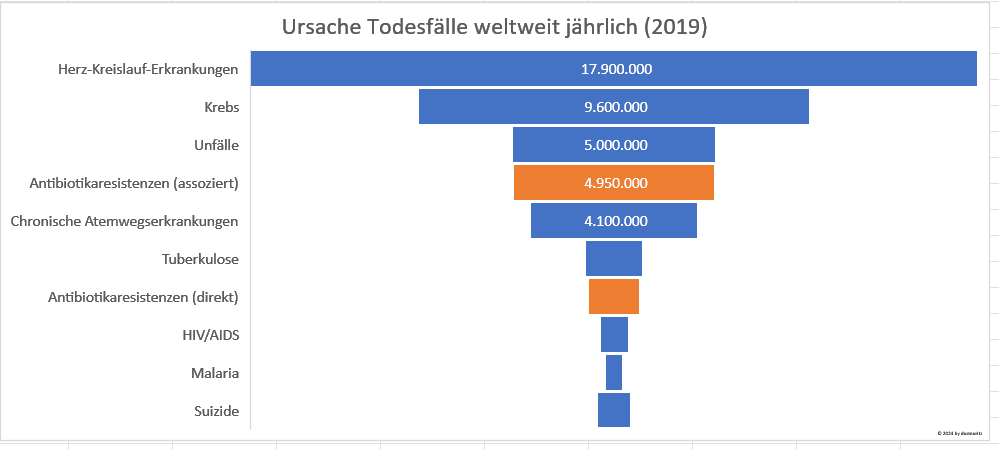
Im Vergleich zu Herz-Kreislauf-Erkrankungen mit etwa 17,9 Millionen Todesfällen jährlich, gefolgt von Krebs mit 9,6 Millionen, chronischen Atemwegserkrankungen verursachen etwa 4,1 Millionen Todesfälle, während Tuberkulose für etwa 1,4 Millionen, HIV/AIDS für 690.000, Malaria für 400.000 Todesfälle jährlich verantwortlich sind. Unfälle führen bis zu 5 Millionen und Suizide zu etwa 800.000 Todesfällen pro Jahr, wobei hier die tatsächliche Zahl aufgrund von Unterberichterstattung höher sein könnte.
Zusätzlicher ökonomischer Impact: Die ökonomischen Auswirkungen sind ebenfalls enorm. Geschätze Zahlen liegen mir nur aus den USA vor. Zusätzlich zum Verlust an Leben verursacht das Versagen von Firstline-Therapien bei Infektionen jährliche Zusatzkosten von rund 20 Milliarden US-Dollar. Diese Kosten resultieren aus längeren Krankenhausaufenthalten, der Notwendigkeit intensiverer Pflege und teurerer alternativer Behandlungen. Die indirekten Kosten, wie Arbeitsausfall und Produktivitätsverluste, erhöhen die ökonomische Belastung weiter.
Globale Dimension: Antibiotikaresistenzen kennen keine Grenzen. Resistente Bakterienstämme können sich schnell über Länder und Kontinente hinweg ausbreiten. Dies macht es zu einem globalen Problem, das koordinierte internationale Anstrengungen erfordert. Die Weltgesundheitsorganisation hat Antibiotikaresistenzen als eine der größten Bedrohungen für die globale Gesundheit, Ernährungssicherheit und Entwicklung heute identifiziert.
Folgen für das Gesundheitssystem: Krankenhäuser und Gesundheitseinrichtungen stehen im Zentrum dieser Krise. Infektionen durch resistente Bakterien sind oft schwer zu behandeln, führen zu längeren Krankenhausaufenthalten, erhöhter Morbidität und Mortalität sowie zu einer erheblichen Belastung der medizinischen Ressourcen. Die steigende Zahl resistenter Infektionen zwingt medizinische Einrichtungen, mehr Ressourcen aufzubringen, um diese Herausforderung zu bewältigen. Gerade in der aktuellen Diskussion um mangelhafte Ressourcen ein nicht zu unterschätzender Aspekt der dringend mehr Aufmerksamkeit bräiúchte!
Folgen für Betroffene: Antibiotikaresistenzen führen zu direkten, spürbaren Auswirkungen auch für die betroffenen Personen. Sie bedeuten oft längere Krankheitsverläufe, erhöhte Risiken bei medizinischen Eingriffen und eine generelle Unsicherheit über die Behandlungsaussichten. Für Patienten resultieren daraus nicht nur physische Leiden, sondern auch eine erhebliche psychische und finanzielle Belastung. Längere Krankenhausaufenthalte und intensivere Behandlungen belasten die Betroffenen und ihre Angehörigen und treiben Kosten in die Höhe. Die erhöhte Mortalität bei resistenten Infektionen macht Antibiotikaresistenzen nicht nur zu einem abstrakten medizinischen, sondern einem konkreten, persönlichen Anliegen, das dringend angegangen werden muss.
Die Geschichte der Antibiotikaresistenzen
Historische Entwicklung der Antibiotikaresistenzen
Bakterien besitzen natürliche Mechanismen, um sich gegen schädliche Einflüsse zu wehren, die lange vor der Entdeckung und Verwendung von Antibiotika durch den Menschen existierten. Diese Mechanismen sind Teil ihrer Überlebensstrategie und ermöglichen es ihnen, sich an eine Vielzahl von Umgebungen anzupassen, gegen Bedrohungen und auch gegen Antibiotika zu verteidigen. Hierzu gehören genetische Mutationen, die bei jeder Zellteilung auftreten können, und Anpassungen ermöglichen, die ihre Überlebensfähigkeit steigern. Effluxpumpen pumpen aktiv schädliche Substanzen aus der Zelle, ein Mechanismus, der ursprünglich zum Schutz vor natürlichen Giften diente. Zudem produzieren einige Bakterien Enzyme, die spezifische gefährliche Stoffe zerstören können, wie das Beta-Laktamase-Enzym, das bestimmte Moleküle spaltet. Schließlich können Bakterien durch Veränderungen in ihren Zielstrukturen, etwa durch Mutationen oder Modifikationen, die Wirksamkeit schädigender Einflüsse verringern. Diese natürlichen Abwehrmechanismen tragen dazu bei, dass Bakterien sich in einer Vielzahl von Umgebungen behaupten können.
Die Geschichte der Antibiotikaresistenzen ist fast so alt wie die Geschichte der Antibiotika selbst. Schon kurz nachdem Alexander Fleming 1928 Penicillin entdeckte, begannen Wissenschaftler das Phänomen der Resistenz zu beobachten. Bakterien, die anfangs auf das Antibiotikum ansprachen, entwickelten Mechanismen, um dem Angriff zu widerstehen.
Frühe Entdeckungen und Warnungen: Bereits in den frühen 1940er Jahren, als Penicillin breit eingesetzt wurde, gab es Berichte über resistente Staphylococcus-Bakterien. Fleming selbst warnte in seiner Nobelpreisrede 1945 vor den Gefahren der unsachgemäßen Verwendung von Antibiotika und der daraus resultierenden Resistenzentwicklung.
The time may come when penicillin can be bought by anyone in the shops. Then there is the danger that the ignorant man may easily underdose himself and by exposing his microbes to non-lethal quantities of the drug make them resistant. Here is a hypothetical illustration. Mr. X. has a sore throat. He buys some penicillin and gives himself, not enough to kill the streptococci but enough to educate them to resist penicillin. He then infects his wife. Mrs. X gets pneumonia and is treated with penicillin. As the streptococci are now resistant to penicillin the treatment fails. Mrs. X dies. Who is primarily responsible for Mrs. X’s death? Why Mr. X whose negligent use of penicillin changed the nature of the microbe. Moral: If you use penicillin, use enough
„Es könnte eine Zeit kommen, in der Penicillin von jedem in den Läden gekauft werden kann. Dann besteht die Gefahr, dass der unwissende Mensch sich leicht unterdosieren und durch das Aussetzen seiner Mikroben an nicht-tödlichen Mengen des Medikaments sie resistent machen kann. Hier ist eine hypothetische Illustration. Herr X. hat Halsschmerzen. Er kauft etwas Penicillin und gibt sich selbst, nicht genug, um die Streptokokken zu töten, aber genug, um sie zu erziehen, Penicillin zu widerstehen. Er infiziert dann seine Frau. Frau X. bekommt eine Lungenentzündung und wird mit Penicillin behandelt. Da die Streptokokken nun gegen Penicillin resistent sind, schlägt die Behandlung fehl. Frau X. stirbt. Wer ist primär verantwortlich für den Tod von Frau X? Warum Herr X., dessen nachlässiger Gebrauch von Penicillin die Natur des Mikroben veränderte. Moral: Wenn du Penicillin benutzt, verwende genug.( Deutsche Übersetzung durch den Autor)“
Fleming SA (1945). Penicillin Nobel Lecture, December 11, 1945. (https://www.nobelprize.org/prizes/medicine/1945/fleming/lecture).
Entwicklung und Ausbreitung: In den folgenden Jahrzehnten wurden viele neue Antibiotika entwickelt, aber parallel dazu entwickelten Bakterien auch neue Resistenzmechanismen. Dieser Wettlauf zwischen der Entdeckung neuer Medikamente und der Evolution resistenter Bakterienstämme hat zu einem komplexen globalen Problem geführt. In den 1960er Jahren trat ein bedeutender Wendepunkt ein mit der Entdeckung des ersten Methicillin-resistenten Staphylococcus aureus (MRSA). MRSA war resistent gegenüber Methicillin, einem Antibiotikum, das entwickelt wurde, um Penicillin-resistente Staphylokokken zu bekämpfen. Diese Entdeckung war ein deutliches Signal, dass Bakterien in der Lage sind, selbst gegen neuere und stärkere Antibiotika Resistenzen zu entwickeln. Die Ausbreitung von MRSA in Krankenhäusern und Gemeinschaften weltweit verdeutlichte die Notwendigkeit, Antibiotikaverwendung und Infektionskontrollmaßnahmen zu überdenken.
Im 21. Jahrhundert wurde das Problem noch komplexer mit dem Aufkommen von multiresistenten Bakterien, auch bekannt als „Superbugs“. Diese Bakterienstämme sind gegen mehrere, manchmal alle verfügbaren Antibiotika resistent, was sie extrem schwierig zu behandeln macht. Beispiele für solche Superbugs sind Vancomycin-resistenter Enterococcus (VRE) und Carbapenem-resistenter Enterobacteriaceae (CRE).
Diese Entwicklungen haben die medizinische Forschung und Praxis vor große Herausforderungen gestellt. Neue Antibiotika zu entwickeln ist ein langwieriger und kostspieliger Prozess, und die Anzahl neuer zugelassener Medikamente hat nicht Schritt gehalten mit der Rate der Resistenzentwicklung.
Die Forschung und Entwicklung neuer Antibiotika stehen in einem komplizierten Verhältnis zu den finanziellen Interessen der Pharmaindustrie. Trotz des dringenden Bedarfs an neuen Medikamenten zur Bekämpfung von Antibiotikaresistenzen haben viele Pharmaunternehmen ihre Forschung auf diesem Gebiet in den letzten Jahrzehnten reduziert oder sogar ganz eingestellt. Der Hauptgrund dafür liegt in den ökonomischen Rahmenbedingungen und Anreizstrukturen, die die Entwicklung neuer Antibiotika unattraktiv machen.
Im Vergleich zu Medikamenten für chronische Krankheiten, die über längere Zeiträume regelmäßig eingenommen werden, bieten Antibiotika weniger finanzielle Rentabilität. Sie werden in der Regel nur über kurze Zeiträume verwendet und ihre Wirksamkeit soll durch verantwortungsvollen Einsatz bewahrt werden, was den Absatzmarkt einschränkt. Zudem ist die Entwicklung neuer Antibiotika mit hohen Kosten, langen Entwicklungszeiten und erheblichen Risiken verbunden, dass die entdeckten Substanzen letztendlich aufgrund von Resistenzentwicklung oder unvorhergesehenen Nebenwirkungen nicht erfolgreich sind.
Diese Herausforderungen haben dazu geführt, dass die Antibiotikaforschung im Vergleich zu anderen lukrativeren pharmazeutischen Bereichen an Attraktivität verloren hat. Das Resultat ist eine Forschungslücke, die als „antibiotisches Innovationsdefizit“ bezeichnet wird. In den letzten Jahren haben allerdings einige Regierungen und internationale Organisationen begonnen, auf diese Krise zu reagieren, indem sie Anreize und Förderungen für die Antibiotikaforschung bereitstellen, um die Entwicklung neuer Therapien zu stimulieren.
Zudem erfordert die Bekämpfung der Ausbreitung von Antibiotikaresistenzen einen multidisziplinären Ansatz, der über die Medizin hinausgeht und Bereiche wie öffentliche Gesundheit, Landwirtschaft, Umweltwissenschaft und Politik umfasst.
Die Risiken und Probleme von Antibiotikaresistenzen
Antibiotikaresistenzen bringen eine Vielzahl von Risiken und Problemen mit sich, die sich auf verschiedene Aspekte der Patientenversorgung und der medizinischen Praxis auswirken. Die Konsequenzen für Krankheitsverläufe, Behandlungsprotokolle und Effektivität der Infektionsbehandlung sind tiefgreifend und besorgniserregend.
Veränderte Krankheitsverläufe: Wenn Bakterien gegen Antibiotika resistent werden, können Infektionen, die einst leicht zu behandeln waren, zu schwerwiegenden und langwierigen Krankheitsverläufen führen. Die Zeit bis zur Genesung verlängert sich, die Symptome können schwerwiegender werden und die Wahrscheinlichkeit für Komplikationen steigt. In einigen Fällen führen resistente Infektionen zu chronischen Zuständen oder sind sogar tödlich.
Anpassung von Behandlungsprotokollen: Ärzte stehen vor der Herausforderung, wirksame Behandlungen für resistente Infektionen zu finden. Oft müssen sie auf alternative, weniger wirksame oder stärker nebenwirkungsbehaftete Antibiotika zurückgreifen. Dies erfordert komplexe Entscheidungen, bei denen die spezifische Resistenzlage des Erregers, die verfügbaren Medikamente und die individuelle Situation des Patienten berücksichtigt werden müssen. Dieser Prozess ist nicht nur zeitintensiv, sondern erhöht auch die Gefahr von Behandlungsfehlern.
Folgen für die Gesundheitssysteme: Für Krankenhäuser und Gesundheitssysteme führen Antibiotikaresistenzen zu einer erhöhten Belastung. Längere Krankenhausaufenthalte, intensivere Behandlungen und die Notwendigkeit zusätzlicher Pflege erhöhen die Kosten und binden Ressourcen. Zudem steigt das Risiko von Krankenhausinfektionen mit resistenten Erregern, was die Gesundheit weiterer Patienten gefährden kann.
Bedrohung der medizinischen Fortschritte: Viele der Fortschritte in der Medizin, wie komplexe Operationen, Transplantationen und die Behandlung von Krebserkrankungen, sind abhängig von der Verfügbarkeit wirksamer Antibiotika zur Vermeidung und Behandlung von Infektionen. Antibiotikaresistenzen bedrohen diese Errungenschaften und könnten dazu führen, dass selbst Routineeingriffe wieder riskanter werden.
Ursachen der Resistenzentwicklung bei Bakterien
Nachdem wir die gravierenden Folgen von AMR erkannt haben, ist es entscheidend, die Ursachen zu verstehen. Die Entwicklung von Antibiotikaresistenzen ist ein natürliches Phänomen, das durch verschiedene Faktoren beschleunigt und verstärkt wird. Ein tieferes Verständnis dieser Ursachen ist entscheidend, um wirksame Strategien zur Bekämpfung des Problems zu entwickeln. Hier sind die wichtigsten Faktoren, die zur Resistenzentwicklung beitragen:
Übermäßiger und unsachgemäßer Gebrauch von Antibiotika: Der wohl bedeutendste Faktor für die Entwicklung von Resistenzen ist der übermäßige und oft unsachgemäße Einsatz von Antibiotika in der Human- und Veterinärmedizin. Wenn Antibiotika zu häufig, in unangemessenen Dosen oder für ungeeignete Erkrankungen (wie virale Infektionen) eingesetzt werden, erhöht sich der Selektionsdruck auf Bakterien, Resistenzmechanismen zu entwickeln.
Unvollständige Behandlungen: Wenn Patienten Antibiotika nicht nach Vorschrift einnehmen oder Behandlungen vorzeitig abbrechen, können nicht alle Bakterien abgetötet werden. Die überlebenden, möglicherweise bereits resistenteren Bakterien können sich vermehren und die Resistenz weiter verbreiten.
Globale Verbreitung: Durch globale Reise- und Handelsströme können resistente Bakterienstämme sich schnell über Länder und Kontinente ausbreiten. Dies bedeutet, dass Resistenzprobleme nicht isoliert betrachtet werden können – sie sind globale Herausforderungen, die internationale Koordination erfordern.
Einsatz von Antibiotika in der Landwirtschaft: Der Einsatz von Antibiotika in der Tierzucht, sowohl zur Behandlung von Krankheiten als auch in der Tiermast, trägt ebenfalls zur Entwicklung und Verbreitung von Resistenzen bei. Bakterien aus der Landwirtschaft können auf den Menschen übertragen werden, sei es direkt durch den Kontakt mit Tieren oder indirekt über den Verzehr von kontaminierten Lebensmitteln. In den USA werden etwa 80% der Antibiotika bei Tieren eingesetzt, in Deutschland waren es im Jahr 2016 über 50% der verwendeten Antibiotika. Diese Praxis fördert nicht nur die Entwicklung resistenter Bakterienstämme bei Tieren, sondern auch deren Übertragung auf den Menschen. Zudem führt die Ausscheidung dieser Stoffe zu einer Verunreinigung von Böden und Gewässern, was die Verbreitung resistenter Bakterien weiter begünstigt.
Genetischer Austausch zwischen Bakterien: Bakterien besitzen die Fähigkeit, genetisches Material auszutauschen. Dies ermöglicht ihnen, Resistenzgene, die sie entwickelt oder von anderen Bakterien aufgenommen haben, weiterzureichen. Dieser horizontale Gentransfer ist ein entscheidender Faktor bei der schnellen Ausbreitung von Resistenzmechanismen und kann zur Entstehung multiresistenter „Superbugs“ führen.
Natürliche Resistenzmechanismen: Bakterien haben im Laufe der Evolution eine Vielzahl von Mechanismen entwickelt, um sich gegen natürliche Antibiotika zu schützen. Diese Mechanismen können durch genetische Mutationen und den Austausch von genetischem Material zwischen Bakterien verstärkt und verbreitet werden.
Mangel an neuen Antibiotika: Da die Entwicklung neuer Antibiotika langwierig und kostspielig ist und in den letzten Jahrzehnten vernachlässigt wurde, sind die Behandlungsoptionen für resistente Infektionen begrenzt. Dies erhöht den Druck, bestehende Antibiotika einzusetzen, was wiederum den Selektionsdruck auf die Bakterien verstärkt.
Multimodale Ansätze und Innovationen zur Bewältigung von Antibiotikaresistenzen
Angesichts der komplexen Ursachen und schwerwiegenden Folgen von AMR erfordert die Bewältigung dieses Problems innovative, multimodale Lösungsansätze und eine starke interdisziplinäre Zusammenarbeit. Hier sind einige der wichtigsten Strategien und Innovationen, die entwickelt wurden, um diesem globalen Gesundheitsproblem zu begegnen:
Bewusstseinsbildung und Surveillance
Bewusstseinsbildung und Surveillance: Eine verstärkte Bewusstseinsbildung basierend auf wissenschaftlichen Surveillance-Daten ist entscheidend. Es ist wichtig, die internationale Lage zu berücksichtigen und ein umfassendes Bild der Resistenzlage zu erhalten. Nur so können zielgerichtete Maßnahmen entwickelt und implementiert werden.
Hygiene und Primärprävention: Das Entstehen neuer Resistenzen kann durch effektive Hygienemaßnahmen wie die „Aktion Saubere Hände“ und die Entwicklung neuer Impfstoffe, z.B. Pan-Influenza-Impfungen, reduziert bzw. vermieden werden. Diese Präventionsstrategien sind wesentlich, um die Ausbreitung resistenter Bakterien zu kontrollieren.
Stewardship-Programme: Antibiotika-Stewardship-Programme zielen darauf ab, den Einsatz von Antibiotika zu optimieren und Fehlgebrauch zu reduzieren. Dies umfasst Richtlinien für die korrekte Verschreibung, die Förderung der Einhaltung von Behandlungsempfehlungen und die Sensibilisierung von Ärzt:innen und Patient:innen für die Risiken der Antibiotikaresistenzen.
Ausbildung des klinischen Personals: Die Aus- und Weiterbildung des klinischen Personals muss weiterentwickelt werden, um die Komplexität des Antibiotikaproblems vollständig zu erfassen. Durch die Etablierung der Infektionsmedizin als fachärztliche Qualifikation und die Integration von Antibiotic Stewardship-Programmen in die Weiterbildung wird das klinische Personal besser auf die Herausforderungen im Umgang mit Antibiotikaresistenzen vorbereitet.
Forschung und Entwicklung
Forschung und Entwicklung: Die enge Zusammenarbeit zwischen akademischen Einrichtungen und der Industrie ist notwendig, um die präklinische und klinische Entwicklung von Substanzen zu optimieren. Diagnostische Schnelltests und Biomarker für den raschen Nachweis bakterieller Resistenzen müssen entwickelt und in klinischen Studien erprobt werden.
Entwicklung neuer Antibiotika: Auch wenn die Bewältigung von Antibiotikaresistenzen ein breit angelegtes, multimodales Vorgehen erfordert, das über die Entwicklung neuer Antibiotika hinausgeht, kann die Erforschung und Entwicklung neuer Antibiotika zu neuen Behandlungsmöglichkeiten führen.
Antimikrobielle Wirkprinzipien jenseits von Antibiotika: Die Erforschung antimikrobieller Wirkprinzipien jenseits von Antibiotika, wie Immuntherapie und Phagentherapie, ist von großer Bedeutung. Ebenso sollte die geospatiale Verteilung bakterieller Gemeinschaften und deren Beeinflussung durch Methoden wie Mikrobiota-„Transplantation“ und Probiotika weiter erforscht werden.
Komplementärmedizinische Ansätze: Neben pflanzlichen Antibiotika und kolloidalem Silber werden auch Therapieansätze zur Stärkung des Immunsystems durch Ernährung, Lifestyle und ander Massnahmen untersucht und in interprofessionelle Settings integriert. Diese Ansätze bieten alternative Wege, um Infektionen zu behandeln und die Abhängigkeit von traditionellen Antibiotika zu verringern.
Diagnostische Innovationen: Schnelle und genaue diagnostische Tests können dabei helfen, den Einsatz von Antibiotika zu rationalisieren, indem sie schnell die Ursache einer Infektion identifizieren und feststellen, ob und welche Antibiotika wirksam sind. Dies ermöglicht eine gezieltere und effektivere Behandlung.
Um die erforderlichen umfangreichen Anstrengungen in Forschung & Entwicklung zu ermöglichen bedarf es innovativer Finanzierungsmodelle und den Einsatz fortschrittlicher Technologien, die das Potenzial haben, die Forschungslandschaft zu revolutionieren.
Finanzierung und Karriereentwicklung
Finanzierung und Karriereentwicklung: Ein Dachfonds zur Finanzierung der Leitlinienarbeit der Fachgesellschaften und die Förderung von Karriereperspektiven für Clinician Scientists sind entscheidende Schritte. Diese Maßnahmen tragen dazu bei, die Forschung und klinische Anwendung von Antibiotika besser zu vernetzen und zu fördern.
Interdisziplinäre und Interprofessionelle Zusammenarbeit: Die Bekämpfung von Antibiotikaresistenzen erfordert die Zusammenarbeit von Akteuren aus verschiedenen Bereichen, darunter Medizin, Pharmazie, Landwirtschaft, Umweltwissenschaft und Politik. Diese Berufsgrenzen überschreitende Zusammenarbeit ist entscheidend, um umfassende und nachhaltige Strategien zu entwickeln und umzusetzen.
Globale Initiativen und Partnerschaften: Internationale Organisationen und Initiativen wie die Weltgesundheitsorganisation (WHO) und die Globale Allianz für Antibiotika-Forschung und -Entwicklung (GARDP) spielen eine wichtige Rolle bei der Koordinierung der globalen Anstrengungen, der Förderung von Forschung und Entwicklung und der Umsetzung von Politiken zur Bekämpfung von Antibiotikaresistenzen.
Finanzmodell für einen Impact-Investmentfonds: Traditionelle Finanzierungsmodelle, die an rein wirtschaftlichem Proift orientiert sind, stoßen in der Antibiotikaforschung an ihre Grenzen. Hier setzen ‚Impact-Investmentfonds‘ an: Sie sind speziell darauf ausgerichtet, Projekte mit gesellschaftlichem Nutzen zu unterstützen, indem sie die notwendigen finanziellen Ressourcen bereitstellen, um dringende medizinische Herausforderungen wie die Antibiotikaresistenz anzugehen.
Im Jahr 2020 hat die WHO ein „Ein Finanzmodell für einen Impact-Investmentfonds1 zur Entwicklung antibakterieller Behandlungen und Diagnostika (A financial model for an impact investment fund for the development of antibacterial treatments and diagnostics)“ veröffentlicht:
This financial model was prepared as part of an overall project on setting up an impact investment fund to foster development of new antibacterial treatments. It can be used by any company, private or public investor to model cost, and risk of antibiotic development. It may also assist public entities and decision makers in calculating the possible amount and assessing the impact of instruments such as market entry rewards or milestone prizes to pull more investment into antibiotic research.
Dieses Finanzmodell wurde als Teil eines Gesamtprojekts zur Einrichtung eines Impact-Investmentfonds zur Förderung der Entwicklung neuer antibakterieller Behandlungen erstellt. Es kann von jedem Unternehmen, privaten oder öffentlichen Investor verwendet werden, um Kosten und Risiko der Antibiotikaentwicklung zu modellieren. Es kann auch öffentlichen Einrichtungen und Entscheidungsträgern dabei helfen, den möglichen Betrag zu berechnen und die Auswirkungen von Instrumenten wie Markteintrittsprämien oder Meilensteinpreisen zu bewerten, um mehr Investitionen in die Antibiotikaforschung zu ziehen.
https://www.who.int/publications/i/item/a-financial-model-for-an-impact-investment-fund-for-the-development-of-antibacterial-treatments-and-diagnostics-a-user-guide
Fianzielle Pull-Strategien: Für die Entwicklung neuer Antibiotika hat das schweizerische Staatssekretariat für Wirtschaft (Seco) in Bern folgende Punkte zusammengetragen (Beyer 2024):
- «Abonnement»- oder «Netflix-ähnliche» Modelle: Dabei bezahlen Regierungen ihren Krankenhäusern anstatt für jede Arzneimittelpackung eine Art Gebühr oder Prämie, die es ihnen im Gegenzug erlaubt, das Antibiotikum zu beziehen, wenn sie es benötigen. Grossbritannien hat ein solches Pilotprojekt für zwei neue Antibiotika gestartet.
- Diesem «Abonnement»-Modell folgt in gewissem Sinn der im amerikanischen Kongress eingereichte Pasteur Act. Dieser will die Zahlung von der Menge entkoppeln und über die nächsten zehn Jahre zwischen 750 Millionen und 3 Milliarden Dollar pro neues Antibiotikum auszahlen.
- Schweden führt in einem Pilotprojekt Extrazahlungen für bestimmte Antibiotika ein, wenn Mindestumsätze nicht erreicht werden.
- Deutschland hat Reserveantibiotika von der normalen Festsetzung der Preise ausgenommen, sodass höhere Preise festgelegt werden können.
- Diskutiert werden auch übertragbare Exklusivitätsgutscheine, die an Unternehmen vergeben werden, die ein neues innovatives Antibiotikum gegen kritische Bakterien auf den Markt bringen. Der Gutschein würde nach Ablauf des Patents ein zusätzliches Jahr der Marktexklusivität bieten, den das Unternehmen für ein anderes Produkt verwenden oder an ein anderes Unternehmen verkaufen könnte.
Künstliche Inzelligenz und Forschungsbeschleunigung
Neben finanziellen Innovationen spielt die Verwendung technologischer Fortschritte der Informationsverarbeitung eine entscheidende Rolle bei der Überwindung der Antibiotikaresistenz. Künstliche Intelligenz (KI) bietet neue Wege, um die Entwicklung von Antibiotika zu beschleunigen und zu verbessern, indem sie aus einer Fülle von Daten lernt und Muster erkennt, die für den Menschen zu komplex sind.
So bietet eine Kombination von Wissensdatenbanken und Künstlicher Intelligenz (KI) die Möglichkeit, die aussichtsreichsten Kandidaten für die weitere Synthese zu identifizieren. Durch die Anwendung von KI können Forscher aus einer riesigen Menge potenzieller Verbindungen diejenigen herausfiltern, die die größte Wahrscheinlichkeit haben, effektive antibakterielle Behandlungen zu werden. Diese Technologie kann den Prozess der Medikamentenentwicklung beschleunigen, indem sie die Zeit und Ressourcen reduziert, die benötigt werden, um die besten Kandidaten zu identifizieren.
Die Entwicklung neuer Derivate von Antibiotika, die bestehende Resistenzmechanismen umgehen, ist aufgrund der zunehmenden Resistenzen gegenüber häufig verwendeten Antibiotika von entscheidender Bedeutung. Eine rationale Priorisierungsstrategie, wie sie für Makrolid-Antibiotika skizziert wurde, nutzt eine Kombination aus Freie-Energie-Simulationen und Quantenmechanik/Molekülmechanik – Berechnungen, um Kandidaten basierend auf ihrer Löslichkeit, Membranpermeabilität und Bindungsaffinität zu evaluieren. Nach der computergestützten Priorisierung werden die aussichtsreichsten Kandidaten experimentell bewertet. Diese Strategie führt zur Erstellung einer gezielten Substanzbibliothek, reich an Verbindungen mit antibakterieller Aktivität, und beschleunigt somit den Entwicklungsprozess neuer Antibiotika.
Ein Beispiel für eine solche Studie ist die von König (König et al., 2021), in der Acylid-Antibiotika untersucht wurden. Die Studie demonstriert, wie computergestützte Ansätze genutzt werden können, um schnelle und strategische Entscheidungen im Entwicklungsprozess von Medikamenten zu treffen. Die erfolgreichsten Verbindungen, insbesondere in Kombination mit dem membranschwächenden Medikament Colistin, zeigten Wirksamkeit gegen Acinetobacter baumanii, Pseudomonas aeruginosa und Escherichia coli, die zu den kritischsten Krankheitserregern der Weltgesundheitsorganisation zählen.
FAQ
Literaturhinweise
König G et al. (2021). Rational prioritization strategy allows the design of macrolide derivatives that overcome antibiotic resistance. Proceedings of the National Academy of Sciences of the United States of America, 118(46):e2113632118.
Addo MM et al. (2017). Antibiotika-Forschung – 5 Jahre danach: was hat sich getan, was bleibt zu tun? Halle (Saale), Deutsche Akademie der Naturforscher Leopoldina e.V. – Nationale Akademie der Wissenschaften (Diskussion / Deutsche Akademie der Naturforscher Leopoldina, No. Nr. 12).
Beyer P. Marktversagen bei der Entwicklung von Antibiotika? [web site]. (https://dievolkswirtschaft.ch/de/2020/11/marktversagen-bei-der-entwicklung-von-antibiotika/, accessed 6 January 2024).
Fussnoten
- „Impact Investing bezieht sich auf Investitionen, die „in Unternehmen, Organisationen und Fonds mit der Absicht getätigt werden, neben einer finanziellen Rendite eine messbare, positive soziale oder ökologische Wirkung zu erzielen“ (https://en.wikipedia.org/wiki/Impact_investing)

